
Balance de ecuaciones químicas por el método ion electrón (medio básico
El método del ion-electrón es una manera en la que podemos ajustar o balancear las reacciones químicas por medio de iones hidrógeno (protones, H + ), iones hidróxido (OH -) y electrones (e - ). El proceso de ajuste será diferente según la reacción ocurra en medio ácido o básico.

𝐁𝐚𝐥𝐚𝐧𝐜𝐞𝐚𝐫 por 𝐢𝐨𝐧 𝐞𝐥𝐞𝐜𝐭𝐫ó𝐧 𝐂𝐮 + 𝐇𝐍𝐎𝟑 → 𝐂𝐮(𝟐+) + 𝐍𝐎 + 𝐇𝟐𝐎 YouTube
Video explicativo para aprender ajuste de reacciones redox por el método del ion-electrón en medio básico. Saltar navegación. Mediateca de EducaMadrid. Iniciar sesión. Video explicativo para aprender ajuste de reacciones redox por el método del ion-electrón en medio básico. Más información. Idioma/s: Materias: Química Etiquetas.

Ajuste de reacciones por el método ión electrón YouTube
4. Ajusta, por el método del ion-electrón en medio ácido, las siguientes reacciones: a) b) a) Primero, calculamos los números de oxidación de todos los elementos, como hicimos en el ejercicio 1 y 2, para ver cuáles cambian al pasar de reactivos a productos: Uno de los elementos que cambia su número de oxidación es el manganeso, pasa de a .

AJUSTAR METODO ION ELECTRON MEDIO BÁSICO QUÍMICA REDOX Mistercinco
Si la ecuación original se da en forma iónica ya se termino de balancear, pero si la ecuación original fue dada en forma molecular se debe verificar el balanceo y en caso encontrarse diferencias se realiza un pequeño tanteo, esto debido a que pueden existir elementos que no hayan cambiado de estado de oxidación y por lo tanto no se hayan.

balancear por el método del ion electrón, teniendo en cuenta el
En el método ion-electrón (conocido también como método de semi-reacciones) la ecuación redox se divide en dos semi-reacciones: una para las reacciones de la oxidación, y la otra para las reacciones de la reducción. Las semi-reacciones se equilibran separadamente y después se suman, dando una ecuación equilibrada de la reacción redox.

Balanceo por ion electrón (Medio básico). Yodo molecular mas hidróxido
Ahora es necesario igualar cada ecuación parcial en cuanto al número de carga, esto se realiza agregando electrones en el primer o segundo miembro de la ecuación. En esta entrada te explico detalladamente como se realiza: Balanceo de ecuaciones redox: Método del número de oxidación. Multiplica cada ecuación parcial por un número.

Sesion 10 Balance DE EcuacionesMÉTODO ION Electron 1123 250522 HNO3
Ejercicio resuelto de selectividad CLÁSICO DE EXAMEN 1. El hierro reacciona con el ácido sulfúrico según la reacción: Fe + H 2 SO 4 → Fe 2 (SO 4) 3 + SO 2 +H 2 O. a) Ajuste las ecuaciones iónica y molecular por el método del ion-electrón. b) Si una muestra de 1,25 g de hierro impuro ha consumido 85 mL de disolución 0,5 M de H 2 SO 4.

Balance de ecuaciones químicas por Ión Electrón en medio ácido YouTube
Con este ejemplo veremos cómo se ajusta una reacción por el método ion - electrón en medio básico. Son siete pasos sencillos que os servirán para ajustar est.

ION ELECTRÓN EN MEDIO ÁCIDO YouTube
Ajustar y completar, por el método del ion-electrón. Anuncio. Reacciones de transferencia de electrones. Ajuste de reacciones. 1. 2. Escribe y ajusta las semirreaccciones de oxidación y. reducción en medio ácido. b.-Identifica, justificando brevemente la respuesta, el agente.

Balanceo por ion electrón (Medio Ácido) con moléculas orgánicas. YouTube
ajustamos electrónicamente: 5e−+8H++ MnO4−→Mn2++4H2O} Para que el número de e−de ambas semireacciones coincida, debemos. 3 multiplicar la primera reacción por 5, así tendremos 5 e- en cada una. 5Ag → 5Ag++5e− 5e−+8H++ MnO4−→Mn2++4H2O. Sumamos ambas semireacciones ya ajustadas obteniendo la reacción iónica ajustada.

Cu + HNO3 ⇨ Cu(NO3)2 + H2O + NO2 (Redox solución) YouTube
) en medio ácido, oxida los iones cloruro (Cl -) a cloro (Cl 2), reduciéndose a sal de cromo (III). a) (1 p) Ajusta por el método ion-electrón la ecuación iónica que representa el proceso anterior. { ó 𝒙 ó : ( 𝑪 − → 𝑪 + −) 𝒙

Como AJUSTAR reacciones REDOX. Mg + HNO3. Ajuste de Reacciones REDOX
En el método ion-electrón (conocido también como método de semi-reacciones) la ecuación redox se divide en dos semi-reacciones: una para las reacciones de la oxidación, y la otra para las reacciones de la reducción. Las semi-reacciones se equilibran separadamente y después se suman, dando una ecuación equilibrada de la reacción redox.

Método de Balanceo Ion Electrón (En medio ácido) YouTube
Ajuste de una reacción por el método del ión-electrón. Medio básico.1.- Identificar los elementos que se oxidan y los que se reducen.2.- Escribir las semirre.

BALANCEO DE ECUACIONES POR ION ELECTRÓN MEDIO BÁSICO YouTube
1. Escribimos la ecuación sin ajustar. 2. Identificamos qué elemento se oxida (semirreacción de oxidación) y qué elemento se reduce (semirreacción de reducción) a partir de los números de oxidación o estados de oxidación de dichos elementos. Para ello usaremos las reglas para la determinación del número de oxidación.
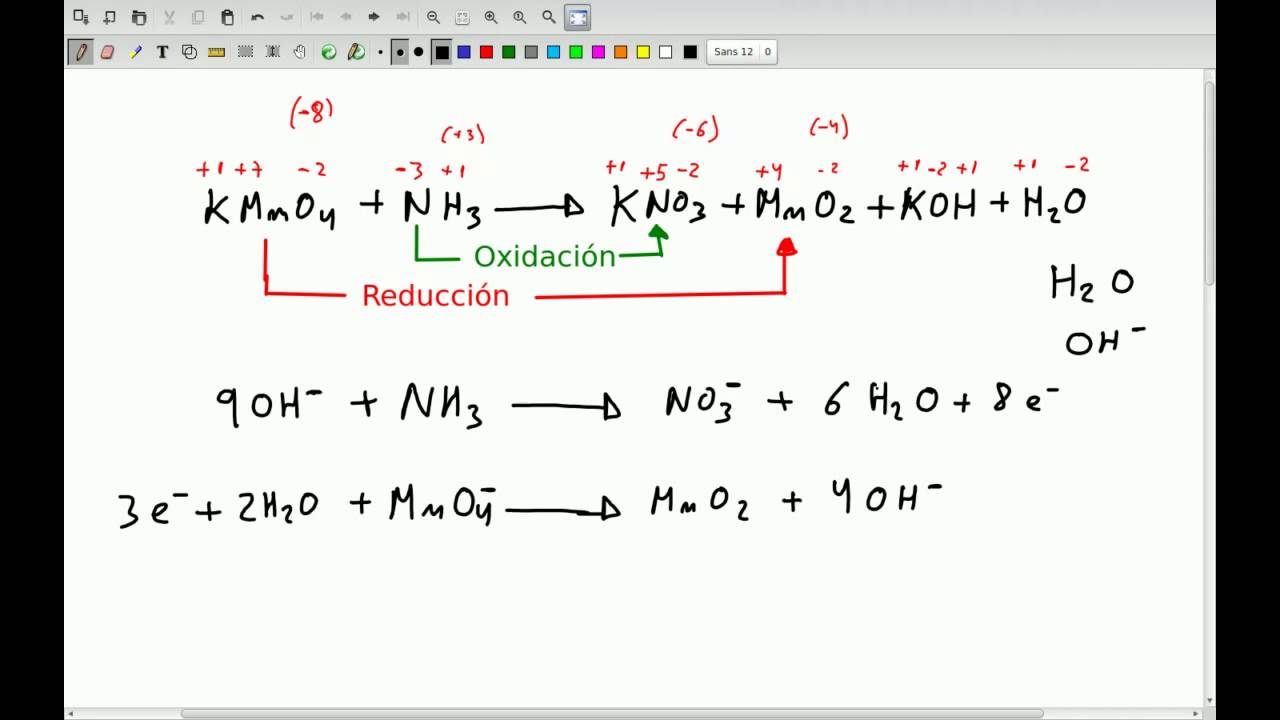
Ajuste por el método del iónelectron en medio basico YouTube
Haremos un ejercicio de QUÍMICA de 2º BACHI. En este caso procederemos a AJUSTAR (Balancear) una reacción por el Método de Ion-Electrón (Oxidación Reducción - REDOX) en MEDIO BÁSICO. Hallaremos las semirreacciones de oxidación y reducción, determinaremos quien es el oxidante y el reductor y ajustaremos electrónicamente las reacciones. Después comprobaremos y tantearemos la.

Como AJUSTAR reacciones REDOX. HNO3 + Zn. Ajuste de Reacciones REDOX
Reacciones redox (oxidación - reducción). Ajustar por el método del ion - electrón.Descargar la ficha adjunta: https://www.academiaalcover.es/wp-content/uplo.
- 30 Herramientas Tic Para Tu Clase De Castellano
- Las Mejores Antenas De Interior Para Tv
- Toyota Jeep For Sale In Pakistan
- Best Toyota Cars Of All Time
- Yate Lexus Ly 650 Precio
- Flora De Fuerteventura
- Ensalada De Pasta Con Verduras Asadas
- Libros Para Encontrar La Paz Interior
- Flores De Organza Como Hacer
- Tabla De Dureza De Aceros Al Carbono